- CHOLESTÉROL
- CHOLESTÉROLLe cholestérol est une biomolécule très répandue chez la plupart des organismes animaux, mais absente des végétaux et des micro-organismes.Le cholestérol est un solide blanc, cristallin, insoluble dans l’eau, soluble dans les liquides organiques hydrocarbonés solvants des lipides.Baptisée «cholestérine» (du grec «chole», bile, et «stereos», solide) par le chimiste français Chevreul en 1815, puis «cholestérol» par Berthelot en 1859, à cause de la fonction alcool qu’elle porte, la molécule de cholestérol existe dans les cellules ou les liquides biologiques sous forme libre ou sous forme combinée. Les fonctions physiologiques attachées à ces deux formes sont spécifiques.Le cholestérol est pour les animaux un nutriment fondamental. Il est indispensable à ceux d’entre eux qui, comme les insectes, ne peuvent en faire la synthèse. De même il est indispensable à certaines cultures cellulaires de mammifères (il est apporté par le sérum du milieu de culture), ce qu’explique son rôle structural fondamental dans les membranes de ces cellules. C’est ensuite un précurseur des acides biliaires qui favorisent la digestion et l’absorption intestinale des lipides alimentaires, que ce soient des acides gras ou encore des composés liposolubles tels que les vitamines A, D et K. C’est enfin la matière première utilisée dans la synthèse d’hormones intervenant dans la régulation des métabolismes.L’implication du cholestérol dans diverses déviations pathologiques, notamment les maladies cardio-vasculaires, justifie l’intérêt que lui porte la recherche biomédicale, souligne son importance physiologique au service de la cellule et de l’organisme.Propriétés et dosageLa structure chimique de la molécule de cholestérol (fig. 1) met en évidence, substitués sur le noyau cyclique planaire, d’une part une chaîne hydrocarbonée hydrophobe sur le carbone 17, d’autre part un groupe OH polaire hydrophile sur le carbone 3. La molécule de cholestérol est une molécule amphiphile, caractéristique à l’origine de ses propriétés physico-chimiques et biologiques.Sur une phase aqueuse les molécules de cholestérol, orientées par la présence du groupe OH, constituent une monocouche ordonnée fluide, chaque molécule occupant une surface de 0,37 nm2. Associées à des molécules de lécithines insaturées en milieu aqueux, les molécules de cholestérol ont un effet condensant, la surface occupée par les molécules de lécithines décroissant de 0,62 à 0,48 nm2 (Lécuyer et Dervichian). La face planaire 見 du noyau du cholestérol entre en interaction hydrophobe liante avec les chaînes carbonées acyl des phospholipides (fig. 2). L’analyse par spectroscopie de résonance magnétique nucléaire et de spin d’électron montre que le cholestérol ordonne les couches mixtes phospholipides-cholestérol et réduit la mobilité des chaînes carbonées insaturées.L’état structural des membranes lipidiques artificielles et des membranes biologiques naturelles est fonction de la température: gel cristallin au-dessous d’une température critique dite température de transition, cristal liquide au-dessus de cette température. La présence de molécules de cholestérol affecte considérablement cette transition, allant jusqu’à l’abolir complètement de telle sorte que, même à des températures infraphysiologiques, la couche lipidique conserve sa structure aérée de cristal liquide (fig. 3).On sait [cf. CRISTAUX LIQUIDES] que certaines molécules organiques de forme allongée se présentent en disposition orientée dans des plans parallèles ou dans des structures hélicoïdales (structure cholestérique) douées d’activité optique. La molécule de cholestérol libre n’est pas mésogène, mais ses dérivés esters tels que benzoate ou oléate le sont. L’existence d’une mésophase nématique ou cholestérique exige une géométrie moléculaire allongée et polarisée. Alors que les dérivés du cholestérol, dont les jonctions de noyaux sont toutes trans, et l’OH3 équatorial sont de structure cristal liquide et mésogènes, ceux de stéroïdes voisins à jonction cis et OH axial, tels que le coprostanol, ne sont pas mésogènes.La séparation et l’isolement du cholestérol libre et de ses esters d’un extrait lipidique, sérique ou tissulaire, sont effectués par chromatographie sur colonne ou sur plaque d’acide silicique à l’aide de différents mélanges éluants.Spécifiquement, le cholestérol libre précipite sous forme d’un complexe avec la digitonine, saponine glysoside d’origine végétale. Cette méthode classique est dépassée en sensibilité par les méthodes de dosages spectrophotométriques et enzymatiques. Citons, entre autres réactions colorées, la réaction de Liebermann-Burchard: cholestérol + acide sulfurique en milieu chloroforme acétique (coloration bleue, absorption à 670 nm) et la réaction de Zlatkis: cholestérol + acide sulfurique en milieu chlorure ferrique acétique (coloration rouge, absorption à 550 nm).On dispose de méthodes de dosage susceptibles d’être automatisées, par exemple la méthode enzymatique CHOD/PAP fondée sur l’oxydation par la cholestéroloxydase du cholestérol en 4 cholesténone + H22 et l’oxydation d’un phénol par la peroxydase en présence de cet H22.Biosynthèse du cholestérolLe cholestérol de l’organisme a une origine double: exogène par l’apport alimentaire, endogène par biosynthèse. L’apport alimentaire étant généralement faible, moins de 1 g par jour, l’activité de biosynthèse est déterminante.La plupart des tissus animaux sont capables de synthétiser le cholestérol, mais les tissus les plus actifs sont le foie et la muqueuse intestinale. Le cholestérol synthétisé journellement par l’homme (de 1,5 à 2 g) provient, pour plus de la moitié, de l’activité hépatique. De fait, la teneur du plasma en cholestérol – cholestérolémie – est réglée principalement par la synthèse et l’utilisation métabolique du cholestérol dans le foie.La nature des précurseurs et le mécanisme chimique de biosynthèse ont été établis, grâce au marquage isotopique au 14C, principalement par les équipes de Bloch, Cornforth et Popjack.La voie de synthèse utilise un précurseur commun à la synthèse des acides gras, la molécule dicarbonée acétyl-coenzyme A, et procède par condensations successives de molécules à squelette terpénoïde (fig. 4). L’étape de la conversion de l’hydroxyméthylglutaryl CoA en mévalonate, acide-alcool en 6C, est critique pour l’ensemble. Elle est en effet irréversible et déterminante pour la suite des réactions conduisant à la molécule du cholestérol.À la suite de plusieurs réactions de condensation, il se forme une molécule à 30 carbones, le squalène (ainsi nommé à cause de sa présence dans le foie des squales). Une réaction concertée de cyclisation, portant sur son dérivé 2-3, époxy, transforme le squalène en lanostérol. Les enzymes en jeu sont alors portées par la membrane du réseau endoplasmique de la cellule.Schématiquement, deux voies conduisent ensuite au cholestérol: via le lathostérol ( 7 cholesténol) dans le foie, via le desmostérol dans le système nerveux (fig. 4). Ces deux voies coexistent dans les cellules embryonnaires, mais rapidement la voie du lathostérol devient prédominante dans le foie. La présence de desmostérol dans certaines tumeurs cervicales signe le souvenir de la synthèse active de cholestérol qui caractérise les cellules nerveuses en développement.La biosynthèse du cholestérol dans le foie du mammifère manifeste un rythme nycthéméral en relation avec le rythme de l’alimentation. Chez le rat c’est en période nocturne qu’elle est la plus active.Chez certains animaux tels que le rat, l’activité de l’enzyme clé qu’est l’hydroxy-méthyl-glutacyl CoA réductase est sujette à un contrôle régulateur négatif (inhibition) par le produit final stérol. Si l’on donne au rat un régime riche en cholestérol, la biosynthèse hépatique de ce dernier est inhibée par ce mécanisme. On croit cette régulation moins efficace chez l’homme, d’autant plus que l’absorption intestinale du cholestérol est limitée (moins de 50 p. 100). Dans les cellules hépatiques et dans les cellules intestinales de l’homme l’inhibition de la biosynthèse du cholestérol par régulation en retour est due moins au cholestérol qu’aux acides biliaires qui en sont dérivés.Cholestérol et membranes cellulairesLe cholestérol est un constituant lipidique constant des membranes cellulaires des animaux, où il s’associe aux phospholipides et aux protéines. C’est dans la gaine de myéline des fibres nerveuses qu’il est le plus abondant (1 molécule de cholestérol libre pour 1 molécule de phospholipide). Dans les autres membranes cellulaires, le cholestérol est en proportion variable, significative dans la membrane plasmique (péricellulaire) et le réseau endoplasmique, pratiquement nulle dans la membrane mitochondriale interne.Dans la couche double lipidique des membranes cellulaires (fig. 5), les molécules de cholestérol sont orientées de façon stricte. La tête polaire du groupe OH, tournée vers la surface, entre ainsi en contact avec le milieu extérieur ou cytoplasmique aqueux, alors que le noyaux et la chaîne carbonée sont au contraire situés en profondeur, en rapport d’interaction liante avec les chaînes carbonées d’acides gras des phospholipides. Du fait de sa configuration stérique, le cholestérol peut s’associer de façon privilégiée avec les molécules de lécithines (phosphatidylcholines) et éventuellement de sphingomyélines.Or, loin d’être des structures rigides stables, les membranes biologiques sont au contraire des structures dynamiques où les molécules sont en mouvement et renouvellement à des vitesses variables. Ces mouvements des constituants membranaires et les phénomènes de transfert transmembranaire des ions et des molécules organiques sont d’autant plus faciles que la membrane est moins rigide, plus fluide. Le cholestérol joue un rôle efficace de modulateur naturel de la fluidité membranaire. Dans le cas d’une structure moléculaire compacte et cohésive, le cholestérol écarte les molécules de phospholipides et augmente la fluidité membranaire. C’est le contraire dans le cas d’une structure lâche où le cholestérol réduit la mobilité des chaînes carbonées, donc diminue la fluidité membranaire; cet effet cohésif concerne particulièrement les molécules de phospholipides renfermant des acides gras insaturés.Outre les phénomènes de perméabilité cellulaire, la fluidité membranaire affecte l’activité des enzymes à localisation membranaire, telle que l’enzyme ATP-ase. Ce facteur de perméation qui assure le transfert des ions Na et K, en hydrolysant l’ATP, est inhibé par une trop forte concentration de cholestérol.L’accumulation intracellulaire pathologique de cholestérol, associé à d’autres lipides, résulte d’apports excessifs ou de défauts du catabolisme. Les xanthomes affectent différents tissus particulièrement la peau et l’os. L’athérome, dépôt de cholestérol dans la paroi des artères, est impliqué dans le développement de l’athérosclérose.Esters de cholestérol tissulairesDans les cellules, le cholestérol est présent principalement sous forme libre. Dans certains tissus toutefois, on trouve des esters de cholestérol en concentration notable: il s’agit alors de formes de réserve du cholestérol. Dans le foie, le cholestérol est ainsi en réserve en vue de sa conversion en acides biliaires et de son exportation au sein des lipoprotéines plasmatiques; dans les surrénales, il est stocké en attendant sa conversion en hormones stéroïdes. Dans les cas pathologiques de stéatose, les formes chimiques de dépôt lipidique sont les triglycérides et les esters de cholestérol. Il en est ainsi du foie et de divers tissus ou cellules comme les macrophages (maladie de Tanger). L’accumulation intracellulaire d’esters de cholestérol peut résulter d’un défaut de l’enzyme hydrolase d’origine lysosomique.La concentration élevée des esters de cholestérol dans le foie des embryons d’oiseaux est à rapprocher de l’importance des esters de cholestérol dans le jaune de l’œuf, forme de réserve à la fois du cholestérol et des acides gras insaturés et polyinsaturés nécessaires au développement.Stéroïdes dérivés du cholestérolAu cours du catabolisme du cholestérol le noyau de la molécule n’est généralement pas dégradé. Le cholestérol est transformé en stéroïdes qui sont finalement excrétés par voie intestinale: acides biliaires, hormones stéroïdes corticales et sexuelles, cholécalciférol (encore appelé, improprement, vitamine D3 et chez lequel le noyau stérane est coupé).Les acides biliaires sont synthétisés par le foie. Leur formation constitue la principale voie du catabolisme du cholestérol (plus de la moitié du cholestérol synthétisé par le foie). La cellule hépatique synthétise au niveau du réseau endoplasmique les deux acides biliaires dits primaires, l’acide cholique et l’acide chénodéoxycholique. Dans la molécule d’acide biliaire (fig. 6), la jonction des noyaux A et B est de structure cis et les groupes OH sont orientés 見. La chaîne latérale portée par le carbone 17 est coupée par oxydation et réduite à 5 carbones. L’acide cholique détient 3 groupes 見OH, portés par les carbones 3, 7 et 12; l’acide chénodéoxycholique, 2 groupes 見OH en C3 et C7. L’enzyme cholestérol 7 – 見 hydroxylase est l’enzyme clé dans la séquence des réactions de synthèse des acides biliaires.Ces acides sont rapidement conjugués par liaison amide avec un acide aminé, glycine ou taurine, dans les proportions 3 glycine/1 taurine. Les conjugués sont excrétés en solution dans la bile (12 g par litre chez l’homme, seulement 0,5 g de cholestérol). Dans l’intestin, sous l’action des bactéries de la microflore intestinale les sels biliaires sont déconjugués et les acides biliaires primaires sont en partie transformés en acides biliaires dits secondaires, l’acide déoxycholique 3 et 12 – 見OH et l’acide lithocholique 3 – 見OH, éliminés en tant que stérols biliaires. Pour sa part, le cholestérol est converti en coprostérol et cholestanol.En raison de leur caractère amphiphile, les sels biliaires sont des agents tensio-actifs qui permettent l’émulsion des lipides apportés par l’alimentation et participent ainsi à la digestion et à l’absorption intestinale des lipides.Les gouttelettes (micelles) lipidiques dispersées dans le fluide intestinal, de diamètre de l’ordre de quelques nanomètres (10-9 m), portent en surface les molécules de sels biliaires et de cholestérol associées à des molécules de phospholipides et monoglycérides. Elles contiennent les acides gras libérés des triglycérides apportés par les aliments, sous l’effet hydrolytique des lipases, notamment la lipase pancréatique. Les micelles se dissocient au niveau de la bordure en brosse des cellules intestinales et déchargent leurs constituants, ce qui facilite leur absorption au niveau de l’intestin grêle.Dans le gros intestin, les acides biliaires induisent la sécrétion d’eau et d’électrolytes et favorisent ainsi la défécation. L’excès d’acides biliaires peut être cause de diarrhée.Après avoir été déversés dans l’intestin par le canal biliaire, les acides biliaires reviennent en majeure partie au foie par la veine porte, de même qu’une partie du cholestérol de la bile. Les stéroïdes biliaires peuvent circuler ainsi une dizaine de fois en 24 heures avant d’être définitivement excrétés: pour une quantité totale de l’ordre de 3 g, le flux d’acides biliaires dans ce cycle entéro-hépatique est de l’ordre de 25 g par jour chez l’homme.Les calculs biliaires déposés dans la vésicule biliaire résultent de la précipitation du cholestérol lorsque les sels biliaires sont en proportion insuffisante pour assurer sa solubilisation au sein des micelles mixtes transportées par la bile.Hormones stéroïdesLe cholestérol est précurseur des hormones stéroïdes dont l’action s’exerce soit dans le cadre du métabolisme minéral et organique, soit dans le cadre du développement et des fonctions sexuelles. Sans entrer dans le détail des réactions chimiques de ces synthèses hormonales, qui mettent en jeu des enzymes à localisation mitochondriale propres aux différentes étapes concernées, on peut remarquer dans tous les organes stérogènes la présence d’intermédiaires communs.Le cholestérol (C27) est converti en prégnénolone (C21) puis en progestérone (C21). Dans le cortex surrénalien, la progestérone est convertie soit en minéralocorticoïdes, actifs sur les mouvements de l’eau et des électrolytes, soit en glucocorticoïdes actifs sur la synthèse des sucres. Dans les glandes sexuelles, la testotérone (C19) est un précurseur commun aux hormones sexuelles mâles, telles que l’androstérone (C19) et aux hormones sexuelles femelles telles que l’œstrone (C18).Cette séquence de précurseurs communs aboutissant à des hormones spécifiques est susceptible de déviations quantitatives qui se traduisent par des symptômes anormaux tels que le virilisme surrénalien.CholécalciférolC’est dans la peau, plus précisément dans l’épiderme, que s’effectue la conversion du cholestérol en cholécalciférol. La molécule de cholestérol est oxydée en 7,8-déhydrocholestérol. Ce stérol, sous l’action des rayons ultraviolets du spectre solaire, subit une coupure de son noyau moléculaire entre les carbones 9 et 10 (sécostéroïde) et un réarrangement de conformation en cholécalciférol. Le cholécalciférol est transporté par le sang et sera converti, successivement par le foie puis par le rein, en dérivé dihydroxylé, 1,25 見OH cholécalciférol, forme physiologiquement active sur l’entrée et le métabolisme du calcium dans l’organisme.Cholestérol plasmatique et lipoprotéinesLe cholestérol circulant dans le sang, de l’ordre de 2 g par litre chez l’homme, soit 11 g au total, se distribue pour moitié dans les globules rouges et pour moitié dans le plasma ; la cholestérolémie (taux plasmatique du cholestérol) est de l’ordre de 2 g par litre. La cholestérolémie varie avec le sexe, l’âge (de 1,7 chez le jeune à 2,5 g/l vers 50 ans) et le régime alimentaire de l’individu.De même que les autres composés lipidiques, phospholipides et triglycérides, le cholestérol, insoluble dans l’eau, est transporté au sein d’entités spécifiques du plasma, les lipoprotéines. Dans ces particules qu’on peut classer d’après leur densité et leurs caractères physico-chimiques en différentes populations, le cholestérol est présent soit sous forme libre, soit sous forme estérifiée. Au total, le rapport de ces deux formes (libre/estérifiée) est de 1/2.Ce sont les lipoprotéines VLDL à très faible densité (0,960 à 1,006 g/l) et surtout LDL à faible densité (1,006 à 1,063 g/l) qui sont les plus riches en cholestérol, au moins chez l’homme. Il en est différemment d’autres espèces animales. On peut calculer le cholestérol des LDL du plasma humain selon la formule de Friedewald et Frederickson (qui s’applique au cas où le cholestérol est au-dessous de 3 grammes par litre), en déduisant du cholestérol total le cholestérol lié aux HDL, lipoprotéines à densité forte:
 Les esters de cholestérol plasmatiques sont caractérisés par des acides gras à longue chaîne insaturée, oléique, linoléique et arachidonique. L’origine des esters de cholestérol est double, hépatique et plasmatique, mais probablement surtout plasmatique. Une enzyme du plasma synthétisée par le foie, la lécithine-cholestérol-acyltransférase, catalyse le transfert d’un acide gras estérifiant le glycérol d’une lécithine sur le cholestérol libre des lipoprotéines, réalisant ainsi son estérification. Pour cette raison, il existe une similitude entre la nature des acides gras des lécithines, plus précisément les acides gras en position 2, et celle des esters de cholestérol plasmatiques.Le cholestérol libre des lipoprotéines plasmatiques est en échange très rapide avec le foie dont il provient et divers autres organes. On a pu calculer que chez l’homme environ 20 g sont échangés journellement.Étant donné, d’une part, les besoins des cellules en cholestérol apporté par les lipoprotéines, et, d’autre part, le risque d’accumulation pathologique, la régulation de la captation cellulaire du cholestérol est d’une grande importance physiologique. La régulation porte sur l’entrée du cholestérol, acceptée ou refusée par des récepteurs spécifiques des lipoprotéines à faible densité, situés sur la membrane plasmique (péricellulaire) des cellules. Ces récepteurs, en nombre modulable, sont soumis à une régulation en retour par le cholestérol intracellulaire.Il semble que, dans les tissus autres que le foie, la synthèse du cholestérol est inhibée en raison de leur préférence pour un apport de cholestérol d’origine étrangère. Au contraire, dans le foie et l’intestin, la forte activité de biosynthèse du cholestérol est associée, pour une bonne part, à la formation de cholestérol destiné à être incorporé dans les lipoprotéines et exporté à destination des autres tissus de l’organisme.La régulation de la synthèse du cholestérol par le foie procède d’un mécanisme différent de celui qui porte sur les récepteurs des cellules périphériques aux lipoprotéines. Il s’agit d’une sensibilité particulière au cholestérol d’origine alimentaire qui est apporté au foie par les chylomicrons d’origine intestinale ou leurs dérivés après dégradation intra-plasmatique. Cette différence de réactivité vis-à-vis des formes de transport du cholestérol d’origine endogène hépatique ou exogène alimentaire est probablement déterminante en ce qui concerne les risques de déviation pathologique tels que le risque d’athérosclérose.La régulation du métabolisme du cholestérol et de la cholestérolémie fait intervenir des hormones thyroïdiennes et des hormones sexuelles. Les différentes hormones thyroïdiennes (thyroxine, triiodothyronine) accélèrent à la fois la synthèse du cholestérol hépatique et surtout son catabolisme, la distribution du cholestérol entre les diverses classes de lipoprotéines n’étant pas affectée; il en résulte une baisse de la cholestérolémie. Les hormones œstrogènes font baisser de même la cholestérolémie, mais leur action est plus complexe. Les androgènes, au contraire, ont un effet hypercholestérolémiant.Étant donné que l’hypercholestérolémie est un facteur de risque en pathologie cardio-vasculaire, on a étudié de façon plus approfondie quelles sont les formes de cholestérol plasmatique les plus pathogènes. On a observé une forte corrélation positive entre la teneur en cholestérol des lipoprotéines à faible densité (LDL) et le risque athérogène, et une corrélation négative dans le cas du cholestérol des lipoprotéines à forte densité (HDL). Le rapport du cholestérol des LDL au cholestérol des HDL apparaît ainsi comme un indice de risque plus valable que la cholestérolémie globale. Quant aux HDL, elles auraient un rôle protecteur, car elles diminuent le risque d’athérosclérose chez l’homme.
Les esters de cholestérol plasmatiques sont caractérisés par des acides gras à longue chaîne insaturée, oléique, linoléique et arachidonique. L’origine des esters de cholestérol est double, hépatique et plasmatique, mais probablement surtout plasmatique. Une enzyme du plasma synthétisée par le foie, la lécithine-cholestérol-acyltransférase, catalyse le transfert d’un acide gras estérifiant le glycérol d’une lécithine sur le cholestérol libre des lipoprotéines, réalisant ainsi son estérification. Pour cette raison, il existe une similitude entre la nature des acides gras des lécithines, plus précisément les acides gras en position 2, et celle des esters de cholestérol plasmatiques.Le cholestérol libre des lipoprotéines plasmatiques est en échange très rapide avec le foie dont il provient et divers autres organes. On a pu calculer que chez l’homme environ 20 g sont échangés journellement.Étant donné, d’une part, les besoins des cellules en cholestérol apporté par les lipoprotéines, et, d’autre part, le risque d’accumulation pathologique, la régulation de la captation cellulaire du cholestérol est d’une grande importance physiologique. La régulation porte sur l’entrée du cholestérol, acceptée ou refusée par des récepteurs spécifiques des lipoprotéines à faible densité, situés sur la membrane plasmique (péricellulaire) des cellules. Ces récepteurs, en nombre modulable, sont soumis à une régulation en retour par le cholestérol intracellulaire.Il semble que, dans les tissus autres que le foie, la synthèse du cholestérol est inhibée en raison de leur préférence pour un apport de cholestérol d’origine étrangère. Au contraire, dans le foie et l’intestin, la forte activité de biosynthèse du cholestérol est associée, pour une bonne part, à la formation de cholestérol destiné à être incorporé dans les lipoprotéines et exporté à destination des autres tissus de l’organisme.La régulation de la synthèse du cholestérol par le foie procède d’un mécanisme différent de celui qui porte sur les récepteurs des cellules périphériques aux lipoprotéines. Il s’agit d’une sensibilité particulière au cholestérol d’origine alimentaire qui est apporté au foie par les chylomicrons d’origine intestinale ou leurs dérivés après dégradation intra-plasmatique. Cette différence de réactivité vis-à-vis des formes de transport du cholestérol d’origine endogène hépatique ou exogène alimentaire est probablement déterminante en ce qui concerne les risques de déviation pathologique tels que le risque d’athérosclérose.La régulation du métabolisme du cholestérol et de la cholestérolémie fait intervenir des hormones thyroïdiennes et des hormones sexuelles. Les différentes hormones thyroïdiennes (thyroxine, triiodothyronine) accélèrent à la fois la synthèse du cholestérol hépatique et surtout son catabolisme, la distribution du cholestérol entre les diverses classes de lipoprotéines n’étant pas affectée; il en résulte une baisse de la cholestérolémie. Les hormones œstrogènes font baisser de même la cholestérolémie, mais leur action est plus complexe. Les androgènes, au contraire, ont un effet hypercholestérolémiant.Étant donné que l’hypercholestérolémie est un facteur de risque en pathologie cardio-vasculaire, on a étudié de façon plus approfondie quelles sont les formes de cholestérol plasmatique les plus pathogènes. On a observé une forte corrélation positive entre la teneur en cholestérol des lipoprotéines à faible densité (LDL) et le risque athérogène, et une corrélation négative dans le cas du cholestérol des lipoprotéines à forte densité (HDL). Le rapport du cholestérol des LDL au cholestérol des HDL apparaît ainsi comme un indice de risque plus valable que la cholestérolémie globale. Quant aux HDL, elles auraient un rôle protecteur, car elles diminuent le risque d’athérosclérose chez l’homme.
cholestérol [ kɔlɛsterɔl ] n. m.• 1929; cholestérine 1816; de cholé- et gr. sterros « ferme, consistant »♦ Substance grasse (stérol) qui se trouve dans la plupart des tissus et liquides de l'organisme (cerveau, plasma sanguin [env. 1 g/l], bile), provenant des aliments et synthétisée par l'organisme (foie, corticosurrénale). Le cholestérol peut former des calculs biliaires et provoquer l'artériosclérose. Taux de cholestérol (⇒ cholestérolémie) . Aliments riches en cholestérol. — Cour. Avoir du cholestérol, une cholestérolémie élevée. ⇒ hypercholestérolémie.
● cholestérol nom masculin (du grec sterros, consistant) Stérol d'origine alimentaire ou synthétisé dans l'organisme, constituant des cellules et intervenant dans la synthèse des hormones stéroïdes. (Le cholestérol est transporté dans le sang en étant lié à des protéines [lipoprotéines]. Selon leur densité, celles-ci déposent le cholestérol sur les parois des artères [« mauvais cholestérol »], ou l'en enlèvent [« bon cholestérol »].) ● cholestérol (difficultés) nom masculin (du grec sterros, consistant) Prononciation [&ph95;ɔ&ph96;&ph89;&ph103;&ph104;&ph89;ɔɔ&ph96;], avec ch- prononcé k. Emploi Avoir du cholestérol se dit dans le registre courant. Recommandation Dans l'expression soignée, préférer : avoir un taux de cholestérol (ou présenter une cholestérolémie) trop élevé(e). ● cholestérol (expressions) nom masculin (du grec sterros, consistant) HDL cholestérol (ou cholestérol HDL), fraction du cholestérol sanguin transportée par des lipoprotéines (substances associant des lipides et des protéines) du type HDL (high density lipoproteins, ou lipoprotéines de haute densité). LDL cholestérol (ou cholestérol LDL), fraction du cholestérol sanguin transportée par des lipoprotéines (molécules associant des lipides et des protéines) du type LDL (de l'anglais low density lipoproteins, protéines de basse densité).cholestéroln. m. Variété de stérol apportée par l'alimentation et synthétisée par le foie, présente dans les tissus et les liquides de l'organisme, dans laquelle on reconnaît auj. plusieurs fractions. En excès, le cholestérol représente un facteur de risque cardio-vasculaire.⇒CHOLESTÉROL, subst. masc.CHIM. Substance grasse de la classe des stérols, se présentant sous forme de cristaux blancs nacrés, contenue dans les cellules et les liquides de l'organisme, et dont la présence en excès dans le sang provoque des troubles. Avoir un taux trop élevé de cholestérol dans le sang :• L'hormone thyroïdienne intervient dans le métabolisme des protides, des glucides et des lipides. Pour ces derniers en particulier elle modifie surtout le taux du cholestérol sanguin.QUILLET Méd. 1965, p. 471.SYNT. Cholestérol acide, aortique, globulaire, plasmatique, sanguin; dosage, variations, élévation, diminution, chute du cholestérol; abaisser le taux du cholestérol, faire baisser le cholestérol.Rem. 1. Synon. vieilli cholestérine, enregistré ds LITTRÉ, Pt ROB. et ds la plupart des dict. techn. La cholestérine sanguine (Ce que la France a apporté à la méd. dep. le début du XXe s., 1946, p. 227). 2. Cholesté(r)- sert de 1er élément à qq. composés du vocab. de la méd. relatif au cholestérol. On rencontre notamment ds la docum. cholestérinémie (ibid., p. 226). Synon. ancien de cholestérolémie (R. SCHWARTZ, Nouveaux remèdes et maladies d'actualité, 1965, p. 146). Présence de cholestérol dans le sang. 3. On rencontre également ds la docum. a) Cholestéatome (de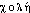 « bile » et
« bile » et 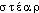 « graisse »), subst. masc. Qui désigne deux variétés de tumeur, l'une dite cholestéatome perlé, petite et bénigne et l'autre cholestéatome massif, se développant autour des plexus du cerveau et du cervelet le plus souvent chez le cheval. b) L'adj. cholestéatomateux qui est attesté une seule fois ds la docum. Aspects cholestéatomateux (Roussy ds Nouv. Traité Méd., fasc. 5, 1920-24, p. 269).Prononc. et Orth. :[
« graisse »), subst. masc. Qui désigne deux variétés de tumeur, l'une dite cholestéatome perlé, petite et bénigne et l'autre cholestéatome massif, se développant autour des plexus du cerveau et du cervelet le plus souvent chez le cheval. b) L'adj. cholestéatomateux qui est attesté une seule fois ds la docum. Aspects cholestéatomateux (Roussy ds Nouv. Traité Méd., fasc. 5, 1920-24, p. 269).Prononc. et Orth. :[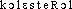 ]. Pour la prononc. de l'initiale par [k] cf. lettre C, graph. ch. Étymol. et Hist. 1816 cholestérine (Chevreul ds Ann. chim. et phys., 2, 346 d'apr. Wexler ds QUEM. : Je nommerai cholestérine... la substance cristallisée dans les calculs biliaires humains); 1929 cholestérol (Lar. 20e). Composé du gr.
]. Pour la prononc. de l'initiale par [k] cf. lettre C, graph. ch. Étymol. et Hist. 1816 cholestérine (Chevreul ds Ann. chim. et phys., 2, 346 d'apr. Wexler ds QUEM. : Je nommerai cholestérine... la substance cristallisée dans les calculs biliaires humains); 1929 cholestérol (Lar. 20e). Composé du gr. 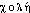 « bile, vésicule biliaire » et du gr.
« bile, vésicule biliaire » et du gr. 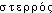 « id. »); suff. -ine et -ol. Fréq. abs. littér. :3.cholestérol [kɔlɛsteʀɔl] n. m.ÉTYM. 1829; de cholestér(ine), et -ol, de stérol.❖♦ Biochim. et cour. Substance grasse (stérol) qui se trouve dans la plupart des tissus et humeurs de l'organisme (cerveau, plasma sanguin — environ 1 g par litre —, bile), provenant des aliments et synthétisée par l'organisme (foie, cortico-surrénale). || Le cholestérol peut former des calculs biliaires et provoquer l'artériosclérose. (→ Athérosclérose, cit. 1). || Taux de cholestérol (ellipt. surveiller son cholestérol).0 De fait, l'état général était à la limite du délabrement. Large excédent de cholestérol. Traces d'albumine. Trace d'urée (…)Jean-Louis Curtis, le Roseau pensant, p. 163.♦ Syn. (vieilli) : cholestérine [kɔlɛsteʀin] n. f. (1816; t. dû à Chevreul; de cholé-, grec stereos « solide », et -ine).❖DÉR. Cholestérolémie. — V. Stérol.
« id. »); suff. -ine et -ol. Fréq. abs. littér. :3.cholestérol [kɔlɛsteʀɔl] n. m.ÉTYM. 1829; de cholestér(ine), et -ol, de stérol.❖♦ Biochim. et cour. Substance grasse (stérol) qui se trouve dans la plupart des tissus et humeurs de l'organisme (cerveau, plasma sanguin — environ 1 g par litre —, bile), provenant des aliments et synthétisée par l'organisme (foie, cortico-surrénale). || Le cholestérol peut former des calculs biliaires et provoquer l'artériosclérose. (→ Athérosclérose, cit. 1). || Taux de cholestérol (ellipt. surveiller son cholestérol).0 De fait, l'état général était à la limite du délabrement. Large excédent de cholestérol. Traces d'albumine. Trace d'urée (…)Jean-Louis Curtis, le Roseau pensant, p. 163.♦ Syn. (vieilli) : cholestérine [kɔlɛsteʀin] n. f. (1816; t. dû à Chevreul; de cholé-, grec stereos « solide », et -ine).❖DÉR. Cholestérolémie. — V. Stérol.
Encyclopédie Universelle. 2012.
